Металлы встречаются в природе и часто используются в качестве основныхматериалов изделий, заготовок, конструкций для промышленности, повседневной жизни. Вещества обладают свойствами, отличающими их от прочих элементов. Рассмотрим виды металла, области его применения и другие особенности.
Что такое металл
Металлы являются обширной группой химических элементов, объединяемых по признакам и от неметаллов отличающихся своими главными характеристиками. В виде простых веществ они демонстрируют металлические специфические свойства, к которым относят блеск, электропроводность, ковкость, теплопроводность, высокую пластичность, температурный положительный коэффициент сопротивления.
Большая часть (свыше 80%) периодической системы, созданной Дмитрием Ивановичем Менделеевым, представлена именно металлами. Но о точном их количестве учёные спорят до сих пор, так как общего правила и единого закона определения принадлежности не существует.
Происхождение названия
Откуда взялось название? Согласно самой распространённой версии этимологии данного термина, слово происходит от латинского «metallum», которое было заимствовано из древнегреческого «μέταλλον», что дословно можно перевести «шахта», «копь», «рудник», «жила». В русском языке название ввели примерно в эпоху Петра I. Предположительно в то время оно пришло на территорию современной России из Франции или Германии.
Историческая справка
Первыми человечество узнало металлы, легко добываемые из природной среды. Это серебро, медь и золото. Далее люди изучали вещества, которые можно выделять. Это ртуть, олово, свинец, железо.
В классификации исторических эпох два временных интервала носят «металлические» названия. Так, период с 3,5 до 1,3 тысяч лет до нашей эры называется бронзовым веком. А время с 1300 года до н.э. примерно до 340 года уже нашей эры – это век железный. Уже тогда человечество не только добывало металлы, но и успешно плавило их и даже создавало сплавы, первым из которых была бронза, ознаменовавшая целую историческую эпоху.
Бронзовые орудия труда и предметы быта археологами были обнаружены при раскопках в более глубоких слоях земли, нежели железные. Работать с бронзой проще, чем с железом, поэтому технологии плавления и соединения меди и олова, из которых состоит сплав, были освоены первыми. И только потом люди научились делать железные предметы.
Согласно принципам алхимии, металлы зарождаются в глубинах земли под воздействием планетарных явлений, обусловленных эволюцией существующих звёзд и других космических тел, непрерывным движением планет, в том числе Земли, а также силой гравитации. Метаморфозы длились столетиями и даже тысячелетиями, и отследить их практически нереально.
Считается, что первыми были драгоценные серебро и медь. Ко вторым открытым относятся ртуть, свинец, медь, железо и олово, обладающие летучестью и наличием состояния жидкости. Они некоторыми исследователями считались особой категорией. А ртуть какое-то время расценивалась основой всех других металлов.
Сурьма, висмут и мышьяк имеют свойства, схожие с металлическими, но не обладают характерной ковкостью. И это подвигло учёных на выделение полуметаллов. Такая классификация использовалась с восемнадцатого века.
Алхимики изначально считали, что сплавы, напоминающие по оттенку золото, преобразуются по процессу превращения в драгметаллы. Учёные полагали, что если изменить лишь цвет, это спровоцирует и качественное изменение. А ещё алхимики были уверены, что сплавы являлись сложными веществами, состоявшими из ртути и серы.
Алхимики пытались ускорять созревание за счёт поддержания оптимальных условий. Превращения считались обычным развитием вещей. И в эпоху таких мыслей зародилась теория философского камня – некой субстанции, которая могла бы любые встречающиеся на Земле металлы превращать в драгоценное золото. Эту идею опровергали многие, среди них был физик и химик Роберт Бойль.
В семнадцатом столетии человечеству стала известна роль атмосферного воздуха в горении. Тогда можно было подумать, что в скором времени решится проблема элементарного состава. Но появляется флогистонная теория, породившая очередной миф. Согласно ему, горение расценивалось распадом. Горючий элемент выделялся пламенем, а оставшиеся компоненты оставались неизменными.
Единые понятия старался сформировать Бехер. Он думал, что в любом металле есть земля трёх сортов: горючая, основная и ртутная. И Бехер основой горючести считал некую неизвестную, получившую название «флогистон». При его взаимодействии с землёй якобы образовывались металлы. Но при обжиге возрастала масса тела. И это означало, что флогистон должен был иметь отрицательное тяготение.
Факт! Ломоносов металлом называл светлое тело, поддающееся ковке. И к таковым отнесли олово, золото, свинец, серебро, железо и медь.
В конце восемнадцатого века Лавуазье разрушил флогистонную теорию, присвоив металлам статус простых веществ. А в 89 году того же столетия учёный представил список, включивший семнадцать металлов. По мере новых исследований данный перечень расширялся. Лавуазье также определил значимость воздуха в горении. Учёный смог продемонстрировать, что, подвергаясь обжиганию, металл становится тяжелее из-за кислородного присоединения.
В девятнадцатом столетии было положено начало классификации редкоземельных элементов. Постепенно открывались новые переменные в химическом анализе минералов. Благодаря спектральному способу исследования мир узнал о рубидии, индии, таллии, цезии.
С середины прошлого двадцатого века используется методика ядерных превращений. Искусственными способами учёные научились получать металлы из категории радиоактивных. В XIX-XX веках металлургия обрела новую, совершенно иную базу. Тогда же велись активные исследования свойств с учётом строения и состава. Сегодня изучение продолжается.
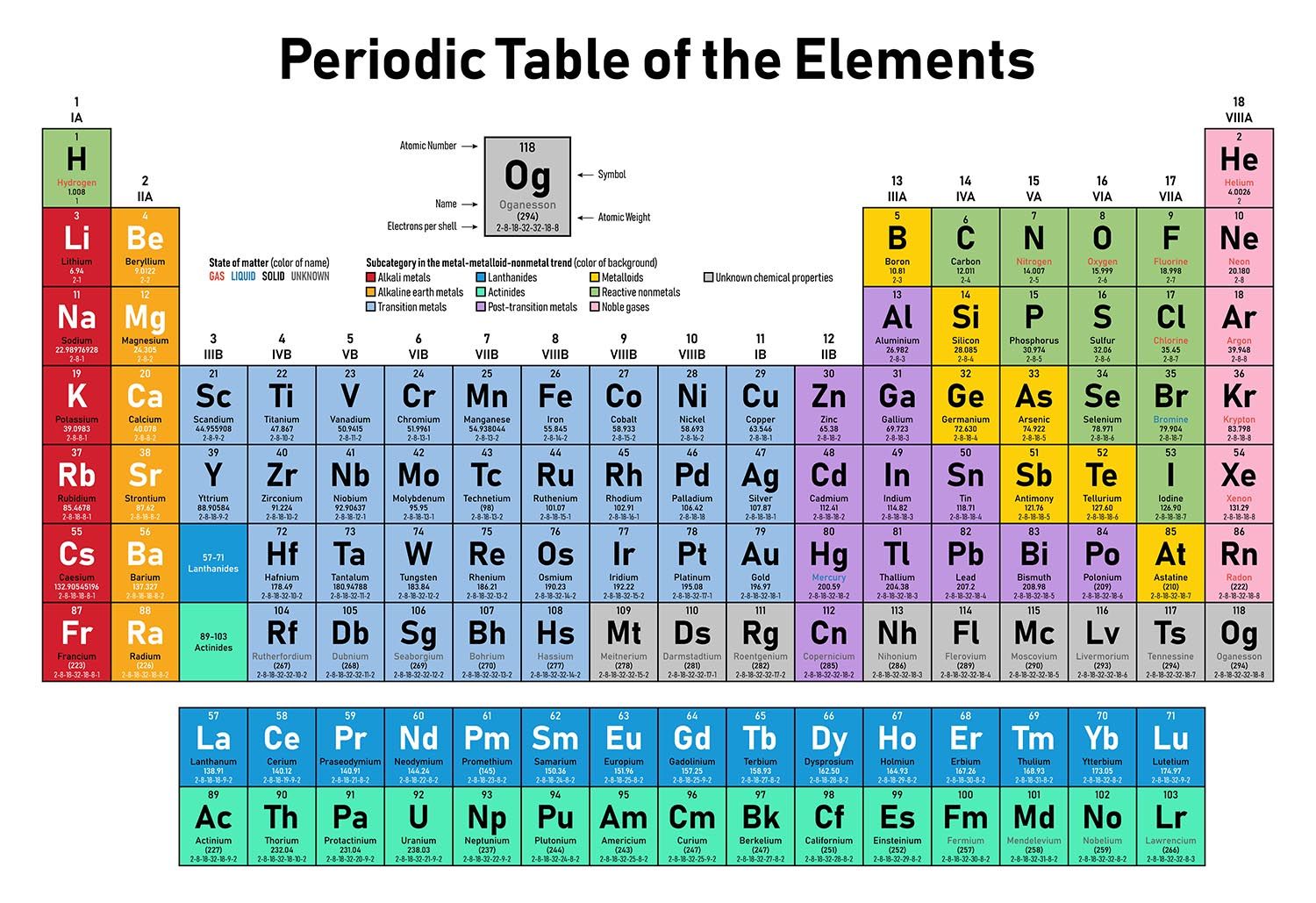
Металлы в периодической системе
Таблица включает 118 разных элементов. Металлы здесь в первой и второй группах. Также они формируют подгруппы в группах с третьей по восьмую. Точное и окончательное количество не определено, так как нет общего правила, а некоторые вещества обладают амфотерностью. При ней демонстрируется двойственность – проявление как основных, так и кислотных свойств при различных условиях.
Как ориентироваться в периодической системе? Все неметаллы в количестве двадцати двух находятся на диагонали, проведённой в таблице от бора (B) до астата (At), а также над этой линией в главных подгруппах. Шесть металлов являются щелочными, ещё шесть – щелочноземельными, семь – лёгкими, тридцать восемь – переходными, ещё семь – полуметаллами. По четырнадцать элементов среди лантаноидов и актиноидов. Ещё четыре металла имеют спорную природу.
Нахождение металлов в природе и их выделение
Большая часть извлекается из земной коры, где металлы встречаются в соединениях. Свободными они содержатся крайне редко. Чистыми реально найти только благородные малоактивные типа серебра, олова, меди, ртути, никеля. Остальные же металлы выявляются в рудах.
Самый распространённый в коре планеты – алюминий, содержащийся в объеме 8,2%. На втором месте железо – порядка 5%. Третий по доле – кальций (3,6%). Далее идёт натрий – 2,8%. Следующий – калий с содержанием 2,6%. Магния в составе чуть больше 2%, а титана – около 0,6%.
Металлы вступают в реакции и формируют сульфиды, оксиды, карбонаты. Для очищения удаляют лишние примеси, содержащиеся в рудах, представляющих собой смеси металлосодержащих минералов, обнаруживаемых в разных породах.

В руде металл, независимо от его типа, пребывает окисленным, поэтому для достижения нужной чистоты применяют восстановление. При наличии в рудном сырье нескольких составляющих практикуют химическое расщепление. Например, при реакциях хлора с полиметаллическими рудами и при воздействии восстановителя формируются хлориды. Они отделяются за счёт разницы летучести. Чистые хлориды возможно до свободного состояния восстанавливать активными металлами.
Редко из полиметаллических руд сплавы выделяются не включающим разделение восстановлением. Если в составе есть затрудняющие восстановительные процессы пустые породы, то осуществляется очистка с обработкой химическим способом, механическим или комбинированным физико-механическим. В последнем случае наиболее часто применяют флотацию, основывающуюся на разнице смачиваемости частиц разных материалов водой.
Чистые оксиды восстанавливать гораздо проще, поэтому водные подвергаются обезвоживанию. А сульфидные руды превращают в оксидные посредством окислительного обжига. Руды с малым содержанием металлов перерабатывают гидрометаллургическими способами – под влиянием водным щелочных и кислотных растворов.
Кроме руд, металлы встречаются в воде морей и океанов, в растениях, животных. Они присутствуют даже в организме человека – около 3%. Максимальной является доля натрия и магния, которые концентрируются в лимфатической системе. Магний также встречается в нервных клетках и в мышечных волокнах. Железо присутствует в крови, а медь есть в печени. Металлы участвуют в метаболизме, играют роль в поддержании жизнедеятельности.
Как добывают металл
Извлечение из недр земли относится к горнодобывающей промышленности. Вещества добываются в карьерах в виде руд. А для выявления мест их расположения применяют особые поисковые методики с разведкой, исследованием рельефа, пластов земли и факторов окружающей среды.

В месторождениях добыча осуществляется с организацией подземных шахт или же тяжёлой техникой. Из добытых руд металлы выделяются электролитическими или химическими способами. Самые распространенные – это:
- Пирометаллургия. Получение или очищение и освобождение от примесей протекает в условиях повышенных температур. Есть несколько разновидностей пирометаллургии. Первая – металлотермия, например, алюминотермия, предполагающая использование Al для извлечения чистых тугоплавких веществ из оксидов. Так добывают хром, молибден. Для работы с хлоридами циркония, тантала применяют магний-термию. Вторая вариация – это карботермия с внедрением углерода, который тоже имеет восстановительную активность и позволяет извлекать из руд мало- и среднеактивные свинец, медь, цинк, железо. Также в пирометаллургии используют водород.
- Гидрометаллургия. Это восстановление из водных растворов металлических солей. Температуры невысокие, комнатные. Извлекаемое вещество в воде находится раздробленным, и для извлечения необходимо добавление активных металлов.
- Электрометаллургия. Для добывания используется ток, пропускаемый через расплав металлической соли либо через её раствор. Электролиз водных сред подходит для обладающих невысокой активностью никеля, серебра, меди. А для алюминия, щелочноземельных и щелочных металлов влиянию подвергают расплавы солей.
В отдельных промышленных отраслях требуются чистые металлы, применяемые для медицинской техники, ядерных реакторов, электроники. При особой чистоте все свойства типа стойкости к коррозии и теплопроводности достигают своих максимальных значений. И такого эффекта достигают следующими методами:
- Термическая диссоциация. Она применима к летучим соединениям, основана на их способности при нагреваниях подвергаться разложению. При термической диссоциации йодиды циркония и титана разлагаются на составляющие – йод и обладающие высокой степенью чистоты металлы.
- Электролитическое рафинирование. Вариант электролиза, предполагающий добавление в качестве активизирующего компонента анода, изготовленного из чернового металла. Последний при прохождении через электролиты тока окисляется, подлежит растворению. А на выполненном из очищенного металла катоде задерживается извлекаемое вещество.
- Зонная плавка. Она основывается на разнице степеней растворимости примесей в разных состояниях: жидком, достигаемом расплавлением, и в твёрдом. Создаётся высокотемпературная зона, через которую с небольшой скоростью движется стержень, изготовленный из подвергаемого очистке металла. По мере перемещения расплавляемый участок, в котором концентрируются лишние примеси, уходит в конец стержневой заготовки. И в горячую зону он в итоге попадает последним. Эта операция выполняется многократно. После каждого её проведения концевая часть стержня с примесями убирается механически.
Строение металлов
Структура представляет собой кристаллическую решётку. В её узлах располагаются катионы, а между ними движутся электроны, формирующие электронный газ. Именно он обусловливает структурную устойчивость. Кристаллическое строение свойственно металлам и сплавам. И их специфические свойства связаны со свободными перемещениями электронов.
Выделяют несколько типов решёток:
- Кубическая объёмноцентрированная. Атомы при ней находятся в вершинах куба, а также в его центре – в точке пересечения диагоналей. Такая структура свойственна калию, натрию, барию, вольфраму, хрому, железу.
- Кубическая гранецентрированная. Атомы располагаются в центральных зонах граней куба, а также в его вершинах. К этому типу решётки относятся серебро, медь, золото, алюминий.
- Гексагональная, встречающаяся у цинка, магния, кадмия. При ней атомы находятся в центре шестигранных оснований призмы, в вершинах данной фигуры, а также в её средней плоскости.
- Тетрагональная. При ней ячейка является прямоугольным параллелепипедом с основанием-квадратом. Такая решётка возникает вследствие растяжения кубической структуры в направлении одного из её векторов. Расположение атомов – в центре и вершинах параллелепипеда. Это характерно для циркония, титана, олова.
Эти четыре типа – самые распространённые. Всего в классификации их четырнадцать. Но остальные 10 у металлов либо не обнаруживаются совсем, либо встречаются очень редко.
Построение решётки правильно, только если затвердевание материала происходило без ускорения синтетическим путём. Если процесс был принудительно ускорен, то строение претерпит изменения. Это называется закаливанием, которое меняет технические и эксплуатационные свойства, а также структуру на молекулярном уровне.
Нарушения производственных технологий в металлургии могут провоцировать замены в решётке. Из-за них кардинально меняются характеристики готовых изделий. Для недопущения таких изменений были разработаны стандарты и нормы, обеспечивающие строгое соответствие готового проката общепринятым требованиям и техническому описанию характеристик.
Атомы в разных направлениях кристалла решётки имеют неидентичную плотность, поэтому свойства различаются. Это называется анизотропией, свойственной монокристаллам, то есть одиночным. Но строение многих металлов поликристаллическое. В их структуре не один кристалл, а множество зёрен, каждое из которых анизотропное. Из-за различной ориентировки определённых зёрен поликристаллические вещества обладают усреднёнными свойствами.
Свойства металлов
Какие свойства металлов определяют характеристики изготавливаемых из данных материалов изделий? Есть несколько типов таких свойств: физические, механические, химические, электрические, технологические, характерные и эксплуатационные. Рассмотрим все подробнее.
Характерные свойства металлов
Все металлы, которые существуют в природе и синтезируются, характеризуются такими специфическими свойствами:
- Блеск, обусловливаемый отражением световых лучей от гладкой поверхности. Но им обладают и некоторые неметаллы, к примеру, углерод, азот. Блеск теряется при нахождении в порошковой форме.
- Особое строение атома. Атомный радиус значительный, на последнем слое располагается от одного до трёх электронов.
- Высокая электропроводность. Эта характеристика металла в разы превышает данное свойство неметаллов, которые проводят ток гораздо хуже.
- Возможность обработки. Она достигается благодаря пластичности – способности менять форму при определённых воздействиях.
- Высокая плотность. Из-за неё металлы по весу обычно превосходят неметаллы.
- Значительная температура плавления, при которой вещества переходят в жидкую форму.
- В химии металлы обычно определяются, как восстановители.
Физические
К физическим относят такие свойства:
- Температура плавления – это значение, при котором вещество из твёрдого состояния переходит в жидкое. Диапазон достаточно широк. Так, ртуть жидкая в обычных условиях, так как плавится уже при -39 градусах Цельсия. А вольфраму свойственна высокая температура, составляющая больше 3 тысяч градусов со знаком плюс. По этому показателю металлы могут быть легкоплавкими, становящимися жидкими при температурах менее 100℃, а также тугоплавкими, плавящимися при критических значениях – больше 1000℃.
- Плотность. По ней металлы классифицируют на лёгкие с плотностью меньше 5 граммов на один кубический сантиметр и тяжёлые с более высокими значениями. К первым относят цезий, литий, а ко вторым – самые тяжёлые иридий и осмий.
- Теплота сублимации. Она характеризует энергию, требующуюся для переведения той или иной массы в состояние пара. Это мера, описывающая прочность связей в структуре.
- Электропроводность. Металлы отлично проводят электроток, так как имеют в структуре подвижные электроны, начинающие перемещаться при влиянии электрического поля. Объясняется это тем, что электроны проводимости взаимодействуют с располагающимися в узлах кристаллов ионами. Самые электропроводные – это алюминий, золото, медь, серебро.
- Теплопроводность. Она тесно связывается с электропроводностью и тоже объясняется подвижностью, присущей свободным электронам, а также с контактированием находящихся в узлах ионов и электронов проводимости.
- Фотоэлектрический эффект. Из-за него вещества со своей поверхности выбрасывают электроны при влиянии электромагнитных волн. Связано это с тем, что валентные электроны несильно связаны с ядром. И чем такая связь меньше, тем проще отрывать электроны.
- Полиморфизм. Он объясняет пребывание в разных формах с различающимися свойствам и структурами.
- Магнитные свойства. Они имеются почти у всех металлов-магнетиков, обретающим либо меняющим магнитный момент под влиянием магнитного поля, прилагаемого снаружи. Существуют диамагнетики, ослабляющие магнитное поле и выталкиваемые из него, ферромагнетики, повышающие силу поля, а также парамагнетики, втягиваемые в поле и усиливающие его в малой степени.
- Цвет. Чаще всего это светлые тона серого, иногда с голубым оттенком. Но золото жёлтое, медь красная, цезий обладает светло-жёлтым цветом.

Электрические
Электропроводность – это следствие присутствия свободных электронов. Они направленно движутся, когда действует электрический ток. Так через металлы электроток проходит без изменения строения, то они являются проводниками первого рода.
При термическом воздействии электропроводность понижается из-за более активных колебательных ионных перемещений, затрудняющих движения электронов. А охлаждение вызывает увеличение электропроводности. При приближении к нулю её значение устремляется к бесконечности. Такое явление получило название сверхпроводимости.
Электрическое сопротивление наблюдается из-за того, что электроны рассеиваются при нарушениях периодичности в кристаллическом решётчатом строении, например, при возникающих дефектах, тепловых ионных колебаниях. Вероятные причины изменений – границы образцов с кристаллами, дислокации, частицы примесей. Сплавы по электрическому сопротивлению обходят чистые породы. У веществ с высоким электрическим удельным сопротивлением наблюдаются локализованные электронные состояния. При этом проводимости нет.
Расплавление обычно не меняет проводимость, но разрушения дальнего порядка провоцируют повышения сопротивления скачками. Но у висмута, сурьмы, галлия при плавлении значение сопротивления растёт.
Химические свойства металлов
Это:
- Восстановительная способность, демонстрируемая в свободном состоянии. Из-за неё степени окисления металлических элементов соединений во всех случаях со знаком плюс.
- Химическая активность, описывающая способность отдавать электроны. Она характеризуется двумя величинами. Первая – энергия ионизации, которая нужна для выведения электрона из атома на расстояние, являющееся бесконечно большим. Вторая величина – электродный потенциал, показывающий способность отдавать свои частицы с отрицательными зарядами в растворах.
- Окисление фтором и возможное окисление хлором. В кислых средах металлы также могут окисляться бромом.
- Формирование оксидов (реже пероксидов) при контактах с кислородом.
- Отсутствие взаимодействия большинства металлов с азотом. Некоторые вещества горят в азотной атмосфере с образованием нитридов.
- Реагирование с серой при нагреве с появлением сульфидов металлов. Особенно быстры реакции с серой после её расплавления.
- Образование гидридов при контактах активных металлов и водорода.
- Формирование пассивных плёнок. Они тормозят реагирование с бромом, кислородом, хлором, фтором. Такие плёнки покрывают металлическую поверхность и обретают инертную, имеющую значительную плотность, высокопрочную структуру.
- Комплексообразование. Оно возможно благодаря свободным орбиталям.
- Токсичность. Например, радий, кадмий, свинец, ртуть, таллий, радий, бериллий, индий в состоянии паров и пыли токсичны.
Механические
Это:
- Твёрдость. Она характеризует сопротивление проникновению в структуру материала более твёрдых тел. Самые мягкие, легко разрезаемые ножом – это металлы щелочной группы. Наивысшей твёрдостью обладает хром, который, подобно алмазу, может разрезать стекло.
- Прочность. Это способность не разрушаться при внешних нагрузках.
- Пластичность. Это способность менять формы при внешних воздействиях, а также сохранять полученные конфигурации после прекращения влияния. Пластичность обусловливается смещением атомных слоёв без разрывания установленных между ними связей. Благодаря данному свойству возможна обработка штамповкой, прокатыванием, прессованием, ковкой. Максимально пластичны золото, медь, серебро.
- Упругость. Возможность восстановления исходных объёмов и габаритов после прекращения нагрузок.
- Вязкость. Это необратимое поглощение энергии при возникновении пластических деформирований.
- Сопротивление усталости. Противостояние постепенному накапливанию повреждений, связанных с переменными напряжениями.
- Хрупкость. Разрушение без видимых пластических деформаций, провоцируемое механическими воздействиями.

Технологические и эксплуатационные свойства
К технологическим свойствам относят:
- Литейные свойства показывают, насколько качественные отливки получаются из сырья. К таковым относят несколько показателей. Ликвация демонстрирует неоднородность химического состава. Усадка – способность менять объём и линейные размеры при процессах охлаждения и твердения. Жидкотекучесть – степень заполнения материалом литейных форм.
- Способность к обработке с применением давления. При ней металл под внешними воздействиями изменяет габариты и конфигурации, но при этом не разрушается.
- Свариваемость. Способность формировать при сварке неразъёмные, обладающие нужным качеством соединения. Мера оценки – состояние сварных швов.
- Способность к обработке путём резания. При ней материал может успешно обрабатываться режущими инструментами. По стойкости последних и по состоянию верхнего слоя металла оценивается способность.
- Деформируемость. Она показывает то, насколько металлические заготовки, не нарушая целостность, могут деформироваться пластически после штамповки, проката, ковки, гибки, прессования, волочения.
- Паяемость. Характеризует образование при паянии герметичных и высокопрочных соединений.
- Упрочняемость. Способность, присущая конструкционным материалам и показывающая, насколько они способны улучшать механические характеристики после специальной обработки (химико-термической с нагреванием и химическими реакциями, термической с нагревом). К упрочняемости относится несколько отдельных критериев. Закаливаемость – степень восприятия металлообработки закалкой. Прокаливаемость – восприятие закалки на те или иные глубины. Незакаливаемость – стойкость к закаливанию.
Эксплуатационные свойства – это:
- Износостойкость. Возможность сохранять изначальные физические характеристики и вид даже после сильного трения.
- Жаростойкость показывает степень сопротивления механическим нагрузкам, оказываемым при повышенных температурных значениях, то есть способность при нагревании не деформироваться, не разрушаться.
- Хладостойкость – способность сохранять прочность и не обретать хрупкость при минусовых температурах.
- Коррозионная стойкость показывает, как материал сопротивляется коррозии.
- Демпфирование – рассеивание, гашение действующих направленно нагрузок, а также колебаний.
- Антифрикционность – способность поддерживать незначительный коэффициент трения скольжения, а также небольшую скорость износа сопряжённых и постоянно трущихся поверхностей.
Виды металлов
По природному происхождению все металлы можно разделить на две большие группы: цветные и чёрные. Выделяют также четыре электронных семейства:
- s. Во внешнем электронном слое их атомов последним происходит заполнение s-подуровня.
- p. Последним в их атомах в электронном внешнем слое заполняется p-подуровень.
- d. В последнюю очередь в них заполнению подлежит d-подуровень электронного предвнешнего слоя.
- f. В атомах элементах из данного семейства в электроном слое, идущем третьим снаружи, заполняется в последнюю очередь f-подуровень.
Также выделяют металлы:
- Щелочные: франций, рубидий, натрий, литий, цезий, калий. Они относятся к первой группе, к её главной подгруппе. Им свойственны мягкость, невысокие температуры плавления, способность к обработке резанием, высокая химическая активность.
- Щелочноземельные: радий, магний, барий, кальций. Они находятся в главной подгруппе второй группы, при комнатных температурах твёрдые, не поддаются резанию, имеют значительную активность.
- Амфотерные, в том числе бериллий, алюминий. Они могут при различающихся условиях вступать в реакции и с щелочами, и с кислотами. Их свойства двойственны.
- Переходные, такие как хром, железо. Эти элементы располагаются в побочных подгруппах и по характеристикам зависимы от степени активности.
Ниже рассмотрим чёрные металлы, а также цветные и существующие сплавы.
Черные
Такие элементы выделяются из руд с применением доменных печей при нагревании до 2 тысяч градусов Цельсия. Они имеют тёмные оттенки, оптимально плотные и твёрдые, плавятся при высоких температурных значениях, широко распространены в современной металлургии и используются для металлопроката, для производств.
Среди чёрных металлов выделяют пять видов:
- Железные. Это само железо, а также марганец, никель и кобальт. Такие элементы в природной среде встречаются наиболее часто, а также становятся основными элементами многокомпонентных сплавов.
- Урановые. Их назначение – применение в атомной энергетики. К такому виду относят плутоний, уран и торий.
- Тугоплавкие. Они расплавляются до жидкого состояния только при очень высоких температурах, за эталон значений которых принимается мера, равная 1539℃.
- Редкоземельные. Это редкие самарий, европий, неодим. Они отличаются дороговизной добывания и обработки, зато в сплавах заметно улучшают или кардинально меняют их характеристики.
- Щелочные. Чистыми практически не используются, подходят для атомной энергетики. В этом списке литий, радий, барий.
Цветные
Такое название присвоено за оттенки, отличные от чёрного. Они варьируются от белого и серебристого до жёлтого и красного. Цветные металлы широко применяются в разных отраслях, делятся на такие подгруппы:
- Лёгкие. Сюда входят литий, стронций, рубидий, титан, алюминий, бериллий. Их удельный вес низок, что обусловливает востребованность в сферах, где нужно сочетание прочности и лёгкости.
- Тяжёлые. К таким относят олово, никель, ртуть, медь, цинк, свинец.
- Благородные. Они называются драгоценными и охватывают вещества, которые мало окисляются, обладают антикоррозионной защитой, имеют высокую и нестабильную стоимость. Это рутений, золото, осмий, платина, родий, серебро.

Тяжёлые металлы дополнительно классифицируют на:
- Легкоплавкие. Это свинец, цинк, олово, плавящиеся при небольших температурных показателях. Легкоплавкие вещества применяются чистыми, вводятся в сплавы для разных целей, служат для соединений и припоев.
- Рассеянные. Они в природе содержатся только в минералах с примесями. В группу вошли гафний, таллий, теллур, рений, индий, германий, селен.
- Тугоплавкие. Это расплавляемые при нагревании до очень высоких температурных отметок тантал, цирконий, хром, марганец, вольфрам, молибден.
- Радиоактивные. В этой группе довольно много элементов, среди которых лоуренсий, фермий, плутоний, нептуний, торий, америций, нобелий, эйнштейний и прочие.
Сплавы
Сплав представляет собой систему, обладающую однородностью и состоящую из нескольких элементов, причём как металлов, так и неметаллов. Обычно есть основа – два или несколько металла. Добавки бывают металлическими и неметаллическими. Они вводятся для придания определённых свойств, к примеру, нужной степени пластичности, твёрдости, эластичности, стойкости к коррозии, мягкости.
Сплавов очень много, среди них выделяют литые, изготавливаемые смешиванием предварительно расплавленных составляющих, и порошковые, получаемые прессованием и дальнейшим спеканием металлических порошков.
По назначению сплавы бывают:
- Конструкционными. Однородные, высокопрочные, плотные, подходящие для производства различных конструкций – техники, транспорта, оборудования.
- Инструментальными. По названию ясно, что из них возможно делать инструменты.
- Специальными. Они идут на производство изделий с особыми свойствами, подходящими для получения специализированных деталей, например, со значительным электрическим сопротивлением.
Самые популярные сплавы:
- Стали, состоящие из железа, углерода в концентрации меньше 2,14 процентов и других вспомогательных добавок. Они бывают легированными, углеродистыми, конструкционными, инструментальными и специальными, такими как подшипниковые, арматурные, строительные.
- Чугуны: графитизированные, отбеленные, белые. В составе железо и от 2,14% углерода.
- Алюминиевые. В их основе – алюминий. Выделяют сплавы порошковые, деформируемые и литейные.
- Медные. Это латуни и бронзы, которые бывают литейными и деформируемыми.
Сферы применения основных металлов
Металлы используют в:
- машиностроении;
- производстве различных инструментов;
- изготовлении бытовой, медицинской техники;
- строительстве;
- авиационной отрасли;
- судостроении;
- ракетостроении;
- изготовлении конструкций: опор ЛЭП, тоннелей, мостов;
- электронике;
- приборостроении;
- получении резисторов, электропроводников, нагревательных элементов отопительного и водонагревательного оборудования;
- создании украшений;
- электротехнике;
- производстве мебели, посуды, нагревательных и отопительных приборов, а также других изделий, используемых в быту.
Все виды и свойства нужно знать при производстве металлоизделий и металлоконструкций, особенно с повышенными требованиями. Специалисты компании Profbau обладают нужными знаниями и учитывают особенности материалов, тщательно подбирают технологии обработки и оборудование с учётом исходных характеристик и желаемых конечных параметров. Мы выполняем заказы любой сложности с профессионализмом и гарантированным качеством. Обратитесь к нам удобным способом, чтобы узнать подробности.











